注册临床试验伦理审查申请
伦理审查申请流程(注册)
一、确认伦理申请类别
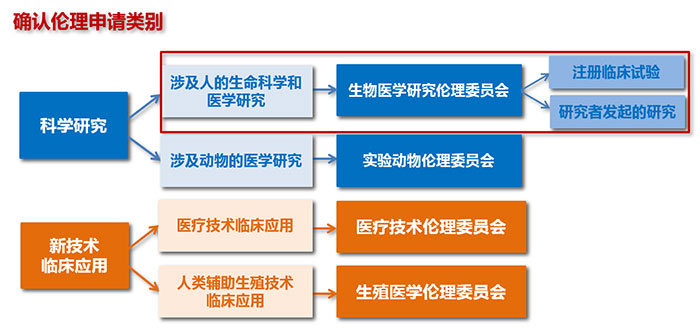
我院生物医学研究伦理委员会审查范围为涉及人的生命科学和医学研究,包括注册临床试验,纵向课题、横向课题及自选课题等研究者发起的研究。
1. 涉及人的生命科学和医学研究:是以人为受试者或者使用人的生物样本、信息数据开展的下列研究活动,均需伦理审查。
(一)采用物理学、化学、生物学、中医药学等方法对人的生殖、生长、发育、衰老等进行研究的活动;
(二)采用物理学、化学、生物学、中医药学、心理学等方法对人的生理、心理行为、病理现象、疾病病因和发病机制,以及疾病的预防、诊断、治疗和康复等进行研究的活动;
(三)采用新技术或者新产品在人体上进行试验研究的活动;
(四)采用流行病学、社会学、心理学等方法收集、记录、使用、报告或者储存有关人的涉及生命科学和医学问题的生物样本、信息数据(包括健康记录、行为等)等科学研究资料的活动。
2. 注册临床试验:是由申办者(通常为企业)发起的以药品、医疗器械(含体外诊断试剂)等产品上市注册为目的、在人体开展的临床试验。
3. 研究者发起研究:是由医疗机构开展的、以人为研究对象,不以产品注册为目的,研究疾病相关及健康维护等研究活动,研究项目包括纵向课题、横向课题及自选课题等。
二、初始审查申请流程(首次提交申请)
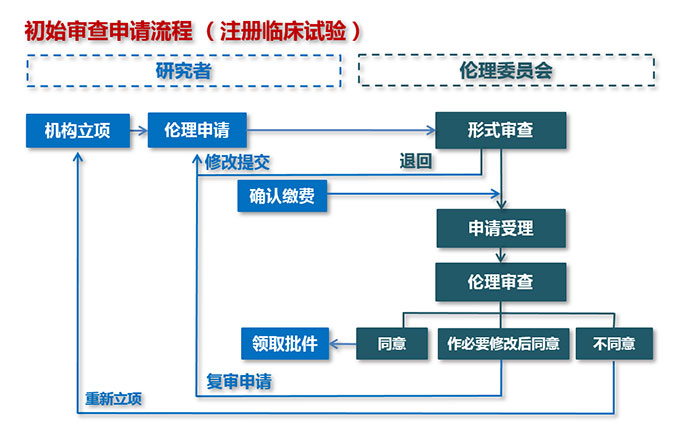
注意事项:
1. 机构立项:根据“医院官网-药物临床试验机构-办事指南-立项流程”进行立项。
2. 伦理申请:首次申请需真阅读“伦理审查申请常见问题与解答”,登录CTMS系统(http://111.203.238.157:8086/ctms/),参考“CTMS操作手册伦理申请(研究者篇) ”,按照送审文件清单(注册)初始审查申请提交文件清单提交申请文件。
3. 确认缴费:按照“伦理审查费缴款指南(注册)”要求和流程缴费。
4. 伦理审查:登录CTMS系统可查看伦理审查结果。“同意”的项目:致电办公室66119025或发送邮件至bdyyec@163.com预约现场办公、领取伦理批件(批件签署日期为系统批准日期);“必要修改后同意/不同意”的项目:系统左下角“消息中心”可查看意见通知函。
5. 复审申请:根据“意见通知函”要求修改相关文件,按照“注册临床试验伦理审查申请”项下,“送审文件清单(注册)” 中“伦理委员会审查意见为‘必要修改后同意’修改后申请时,需提交的文件”,按照CTMS操作手册伦理申请(研究者篇).pdf中“伦理审查复审申请(初审后复审、修正案审查后复审)”操作。
三、跟踪审查申请流程(初始审查同意后)
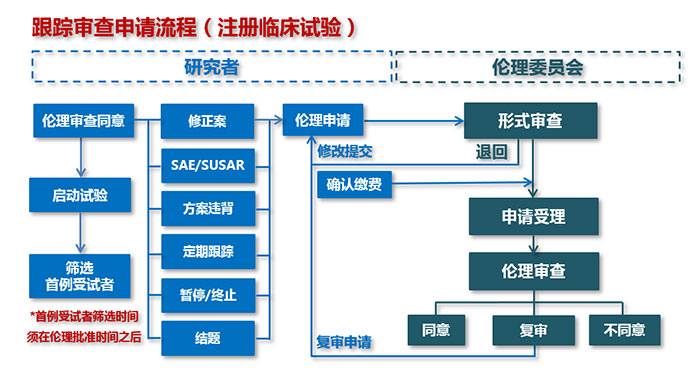
注意事项:
1. 启动试验:向机构办公室申请启动。
2. 修正案:经伦理批准的文件有任何修改都应在实施前报告给伦理委员会(紧急情况除外),包括研究方案、知情同意书、研究手册、招募广告、原始病历、病例报告表、受试者日志卡等。
3. SAE/SUSAR:研究过程中如出现SAE、SUSAR及阶段性报告(DSUR)等安全性事件,应按官网“通知与公告-安全性信息递交伦理委员会时限要求”及时递交。
4. 方案违背:在研究过程中出现的与批准的研究方案不符,或研究者不能遵循要求履行保护受试者的职责或偏离相关原则。
5. 定期跟踪:依照伦理批件中定期跟踪审查频率要求(在批件有效期前1个月申请递交),研究者应及时提交定期跟踪审查相关材料。如获取批件后未及时启动试验,也需在批件中定期跟踪审查间隔时间规定时间内申请定期跟踪审查,否则伦理批件将作废!

6. 暂停/终止:在研究方案没有按照计划完成前,暂停或提前终止该研究。
7. 结题:研究结束后,应向伦理委员会提交完整的书面报告(提交报告摘要即可)。
8. 缴费:根据“伦理审查费缴费指南(注册)”要求和流程缴费。
北京大学第一医院生物医学研究伦理委员会
2024年12月27日







 北京市西城区西什库大街8号
北京市西城区西什库大街8号 100034
100034 83572211
83572211